 |
 |
 |
 |
 |
II期臨床資料為實施關鍵III期臨床試驗奠定了良好基礎。目前,中國抗體正在全力推進RA三期臨床試驗,研究項目進展順利,所有受試者入組將於近期完成。
研究背景及目的:
全球範圍內,~1%的人群深受RA困擾,在中國,約有500萬例RA患者。MTX是RA治療的錨定藥,但在2/3的中重度活動性RA患者中,MTX等傳統改善病情抗風濕藥物(cDMARDs)不僅副作用明顯,而且對疾病的控制程度十分有限。減輕RA疾病活動性、預防關節損傷,或至少阻止關節損傷進展,是當前RA的主要治療策略。在達標治療基礎上,嚴密監測疾病活動度,控制炎症反應,可以有效促進RA患者實現緩解。過去十多年來,以TNF-α抑制劑為代表的生物和靶向合成類DMARDs已使得RA臨床治療發生了極大變化。然而,仍有相當部分患者對上市生物和靶向合成類DMARDs反應不佳,或不能達成疾病的臨床緩解。這說明RA臨床仍需要探索和開發更多新穎機制的靶向藥物。
B細胞靶向療法已在多種B細胞、自身抗體、抗體/免疫複合物介導的疾病中應用(如SLE),並嘗試治療許多T細胞主導的疾病。RA患者的滑膜中既有T細胞、B細胞浸潤,又有巨噬細胞浸潤,這些細胞生成大量促炎因數,導致並加劇關節炎症和損傷。B細胞在RA的炎症級聯反應中發揮著關鍵作用,通過有效的抗原呈遞,可在共刺激信號下啟動T細胞,並產生自身抗體(如RF和抗CCP抗體)以及細胞因數(如TNF-α和IL-1)。這些細胞因數刺激炎症細胞浸潤滑膜,促進淋巴濾泡和血管的形成,加劇滑膜增生和骨質侵蝕。B細胞靶向療法在RA多個病理環節發揮作用,阻斷RA患者滑膜的惡性炎症循環。除利妥昔單抗外,其他更多B細胞靶向的抗體正被開發用於RA。
CD22(Siglec 2),分子量為135 kDa,是一種免疫球蛋白超家族中的1型跨膜唾液酸糖蛋白,主要表達於B細胞,是B細胞受體信號的抑制分子。SM03是一種重組人/鼠嵌合型單克隆抗體,特異性靶向CD22的胞外結構域,具有獨特的免疫調節機制,區別於其它生物靶向藥物。
此前,SM03已在I期臨床試驗中初步顯示治療RA的有效性,此項II期前瞻性、多中心臨床試驗,旨在進一步探索評估SM03治療活動性RA患者的療效及安全性(在穩定劑量MTX背景治療下)。
療效終點
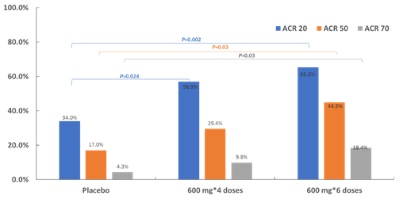
兩個劑量SM03治療組的主要療效指標ACR20應答率均顯著高於安慰劑組,ACR20應答率自第8周開始提高持續至試驗終點24周。同時,24周時高劑量組的ACR50、ACR70應答率均顯著優於安慰劑組(P均=0.03)(圖1)。
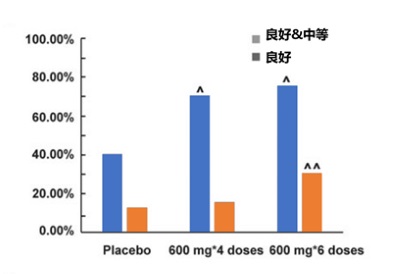
24周時, 高劑量和低劑量SM03組的DAS28-EULAR應答率(moderate+good response)顯著優於安慰劑組(P
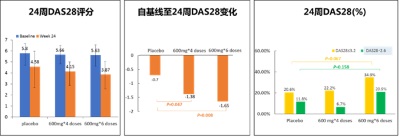
另外,24周時,SM03兩治療組的DAS28自基線改善情況均優於安慰劑組。高劑量組24周達到低疾病活動(LDL)和臨床緩解(remission)者多於安慰劑組(圖3)
安全性終點
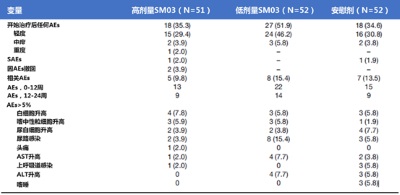
整體上,不良事件(AEs)發生率為40.6%(63/155), 治療組和對照組沒有明顯區別。資料顯示,不良事件多為輕度,三組間的不良事件發生率無顯著性差異(高劑量組35.3%;低劑量組51.9%;安慰劑組34.6%)。接受SM03治療的患者中,有13例(12.6%)患者報告有治療相關感染,其中3.9%患者出現在高劑量組(表1)。
試驗期間沒有患者發生治療相關性嚴重感染、惡性腫瘤或死亡。
抗藥抗體(ADA)和B淋巴細胞變化
SM03治療組僅有個別病例監測到血清低滴度抗藥抗體,未發現ADA與不良反應關聯的臨床意義,提示了SM03低免疫原性特徵。 此外,SM03治療可見外周血B細胞計數的溫和下降,而非上市B細胞單抗的「徹底清除」效應,這可能與SM03安全耐受良好有關。
研究結論:
在接受MTX背景治療的中重度活動性RA患者中,SM03每次600mg、兩種累積劑量3600mg和2400mg,在為期24周的治療期內具有良好的療效及耐受性。與安慰劑相比,SM03可有效降低接受穩定劑量MTX治療的中重度RA患者的疾病活動度,減輕RA症狀和體征。研究顯示,與低劑量SM03相比,高劑量SM03可為RA患者帶來更快、更顯著的臨床獲益。這也支持了在RA患者中開展高劑量SM03的III期臨床試驗。
關於中國抗體製藥有限公司
中國抗體製藥有限公司專注於研究、發展、製造及商業化免疫性疾病療法。公司注重科技研發,其旗艦產品SM03為全球首項用以治療類風濕關節炎的潛在抗CD22單抗,已在中國進入類風濕關節炎三期臨床試驗,並被列為國家十三五重大新藥創制專項重大項目。此外還有多個同類靶點首創(First-in-target)及同類首創(First-in-class)在研藥物,部分已處於臨床階段,適應症覆蓋類風濕性關節炎、系統性紅斑狼瘡、尋常型天皰瘡、非霍奇金氏淋巴瘤、哮喘等具有重大未滿足臨床需求的疾病。
Copyright 2021 亞太商訊. All rights reserved. www.acnnewswire.com





















